非臨床でのがん免疫療法薬の開発をサポート;STAM肝癌モデルの新たな有用性
肝癌モデルとしてのSTAMTM-HCC/IO+モデルの特徴についてご紹介させて頂きます。
下記URLの特設サイトも併せてご覧いただければ幸いです。
https://www.smccro-lab.com/Immuno-oncology/
肝癌は世界で4番目に多い癌であり(Huang DQ et al, Nature Reviews Gastroenterology & Hepatology, 18, 223-238, 2021)、中でも、MASH/NASHに代表されるウイルス性肝炎の関与しない非B非C型の肝癌の割合は、年々増加しております。肝癌の治療薬としては、レンバチニブ、ソラフェニブといった分子標的薬の他、近年アテゾリズマブ+ベバシズマブ、ニボルマブ、ペムブロリズマブといった免疫チェックポイント阻害剤が臨床の現場で使用されています(Chen C et al, frontiers in Immunology, 14, 1133308, 2023)。しかしながら、肝癌に対する免疫チェックポイント阻害剤の奏効率は0~14%と、他の癌腫(例えば、メラノーマの奏効率;35~70%)に比べて低いため、新規治療薬の開発が期待されている状況です(Tan S et al, JACC: CardioOncology, 4, 579-597, 2022, Valero C et al, JAMA Oncology, 7, 1245-1246, 2021)。
腫瘍免疫学におけるSTAMTM肝癌モデルには以下のような利点があります。
• 細胞傷害性T細胞(CD8陽性T細胞)の浸潤細胞数および局在などの評価が可能
• 免疫チェックポイント阻害剤の抗腫瘍効果を評価することが可能
• 標的病変の腫瘍径和の最大変化率をCTにより算出し、腫瘍発育阻害の評価ができる
• 腫瘍の腫瘍遺伝子変異量(Tumor mutation burden)が高い
• 自然発生する肝癌で腫瘍周辺に線維芽細胞、免疫細胞が存在し、免疫抑制性のある腫瘍微小環境を形成しているため、腫瘍微小環境およびそれを形成する因子(immunosuppressive cells、免疫調節サイトカイン/シグナル伝達、代謝異常、腸内細菌叢)を標的にした評価が可能
実際に、STAMTM肝癌モデルを用いた免疫チェックポイント阻害剤(抗PD-L1抗体)およびStroma-modifying drug(TGF-beta中和抗体)の実施をピックアップしご紹介します。本実施例が、STAMTM肝癌モデルを用いた試験をご検討するうえでお役に立てば幸いです。
1. 免疫チェックポイント阻害剤
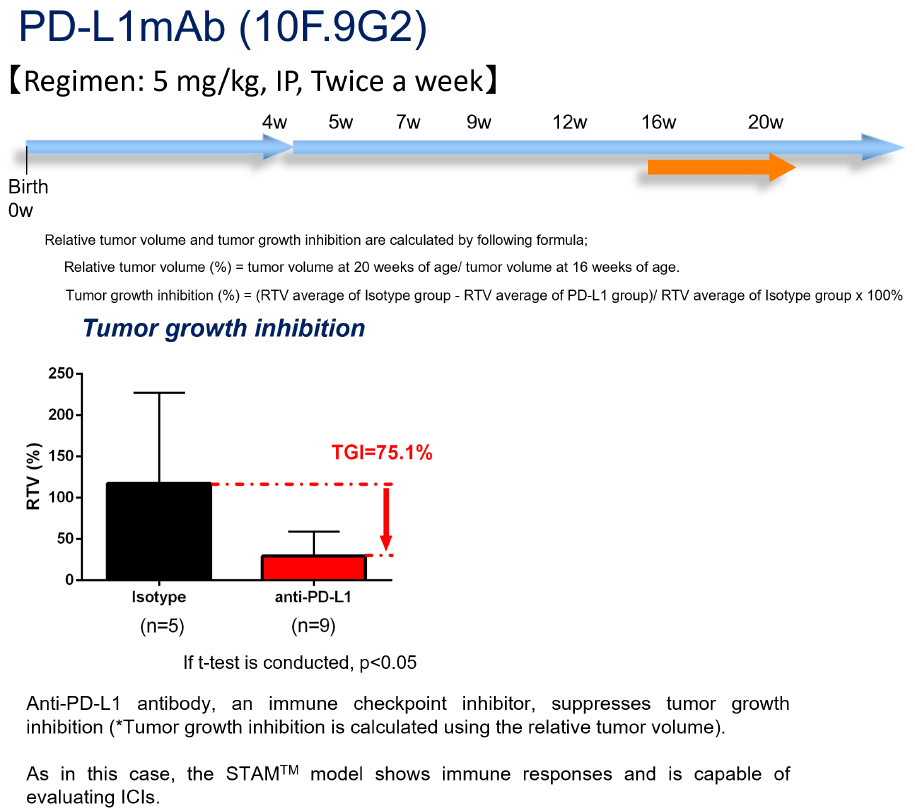
臨床で使用されている抗PD-L1抗体(クローン;10F.9G2)は、STAMTM肝癌モデルを使用した肝癌治療試験において75.1%の腫瘍発育抑制率を示し、腫瘍縮小効果が認められています。
2. Stroma-modifying drug
肝癌治療効果について、Genentech社のOkrahらによりTGF-beta 中和抗体(1D11 antibody)の投与が腫瘍周辺の線維化の改善し、CD8+ T細胞の腫瘍への浸潤を促進させたことにより肝癌治療効果を発揮したことが報告されています(Okrah K et al, NPJ Precision Oncology, 2, 25, 2018)。 臨床の現場で使用されている免疫チェックポイント阻害剤の有効性は、腫瘍微小環境に大きく依存することが報告されています。免疫抑制性の腫瘍微小環境を治療標的とすることは、肝癌治療薬に新たなブレークスルーをもたらすと考えられています(Chen C et al, frontiers in Immunology, 14, 1133308, 2023)。
このようにSTAMTM肝癌モデルは、免疫チェックポイント阻害剤を中心としたimmunotherapyに加えて、腫瘍微小環境を改変するstroma-modifying drugの腫瘍に対する効果も評価できる現在唯一のモデルです。
新規薬剤の評価の他、抗PD-1抗体を含む多彩な免疫チェックポイント阻害剤のmonotherapy試験はもちろん、コンビネーション試験での抗腫瘍効果の評価も可能であり、その抗腫瘍効果を現時点で臨床にて使用されている抗PD-L1抗体を一つの対照として直接比較することができます。
具体的なプロジェクトをお持ちでなくても、お気軽にコンタクトフォームからお問い合わせいただければ幸いです。